Σύνδρομο
Sturge-Weber
Το σύνδρομο Sturge-Weber (SWS) είναι μια τμηματική
αγγειακή νευροδερματική διαταραχή με έναν αστερισμό συμπτωμάτων και σημείων
που χαρακτηρίζονται από :
-τριχοειδικές δυσπλασίες στο πρόσωπο (σημάδι
Port-Wine) και τον εγκέφαλο (λεπτομήνιγγες)
|
Στρώμα |
Θέση |
Χαρακτηριστικά |
|
Σκληρά μήνιγγα (Dura mater) |
Εξωτερική |
Παχιά, ινώδης, κολλημένη στο εσωτερικό του κρανίου. Περιέχει φλεβώδεις
κόλπους. |
|
Αραχνοειδής μήνιγγα (Arachnoid mater) |
Μέση |
Λεπτή, ημιδιαφανής, δεν έχει αγγεία. Βρίσκεται πάνω από τον υπαραχνοειδή
χώρο που περιέχει ΕΝΥ. |
|
Χοριοειδής μήνιγγα (Pia mater) |
Εσωτερική |
Πολύ λεπτή, προσκολλάται άμεσα στον εγκέφαλο και εισχωρεί στις αύλακες.
Πλούσια σε αγγεία. |
-ανώμαλα αιμοφόρα αγγεία του οφθαλμού που οδηγούν
σε γλαύκωμα.
Οι ασθενείς εμφανίζουν επιληπτικές κρίσεις,
ημιπάρεση, επεισόδια που μοιάζουν με εγκεφαλικό επεισόδιο, πονοκεφάλους
και αναπτυξιακή καθυστέρηση.
Περίπου 1 στις 20.000 έως 50.000 ζώντες γεννήσεις
εμφανίζουν SWS.
Φυσιολογία
Οι ετεροτριμερείς G-πρωτεΐνες (heterotrimeric
G proteins) είναι βασικοί μεσολαβητές μεταφοράς σήματος μεταξύ G-πρωτεϊνικών
συζευγμένων υποδοχέων (GPCRs) και ενδοκυττάριων στόχων. Αποτελούν θεμελιώδη
κομμάτι της κυτταρικής φυσιολογίας και ρυθμίζουν πληθώρα λειτουργιών όπως την
όραση, όσφρηση, καρδιακή λειτουργία, έκκριση ορμονών, και μεταβολισμό.
Όσον αφορά την εξειδίκευση υποδοχέα και τελεστή,
καθώς και τις ομοιότητες αλληλουχίας και λειτουργικότητας, η υπομονάδα Gα
μπορεί να χωριστεί περαιτέρω σε τέσσερις οικογένειες: Gαi, Gαs, Gα12 και Gαq.
Η οικογένεια Gαi είναι η μεγαλύτερη και
πιο ποικίλη ομάδα πρωτεϊνών G και αυτές εκφράζονται στα περισσότερα κύτταρα, αν
και υπάρχουν μερικές που είναι ειδικές για νευρώνες, αιμοπετάλια και ραβδία και
κωνία. Το i σημαίνει «αναστολή», καθώς η πλειονότητα αυτών των καθοδικά
σηματοδοτικών αποκρίσεων περιορίζει τη δραστηριότητα των cAMP-εξαρτώμενων
πρωτεϊνικών κινασών.
Η οικογένεια Gαs (s για «διέγερση») έχει
μόνο δύο μέλη. Η Gαs εκφράζεται στους περισσότερους κυτταρικούς τύπους, ενώ η
Gαolf εκφράζεται μόνο σε οσφρητικούς αισθητήριους νευρώνες.
Η οικογένεια Gα12 έχει επίσης δύο μέλη που
εκφράζονται ευρέως.
Τέλος, η οικογένεια Gαq έχει τέσσερα μέλη:
η GNAQ και το παράλογό της Gα11 εκφράζονται παντού, ενώ οι Gα14 και Gα15/16
εκφράζονται σε μαλακά όργανα (νεφρούς, πνεύμονες και ήπαρ) και αιμοποιητικά
κύτταρα, αντίστοιχα.
Δομή των ετεροτριμερών G-πρωτεϊνών
Αποτελούνται από τρεις υπομονάδες:
- Ga : Δεσμεύει GTP/GDP και διαθέτει ενζυμική δραστηριότητα GTPάσης
- Gβ + Gγ :Σχηματίζουν σταθερό διμερές που συμμετέχει επίσης στη σηματοδότηση
Υπάρχουν διάφοροι τύποι Gα (Gs, Gi, Gq, G12/13) —
καθορίζουν τη φύση της σηματοδοτικής οδού.
Μηχανισμός φυσιολογικής δράσης
1️ Ανενεργός κατάσταση
- Το Gα είναι δεσμευμένο με GDP
- Το σύμπλοκο Gα–GDP / Gβγ παραμένει ενωμένο → ανενεργό
2️ Ενεργοποίηση GPCR
- Δέσμευση εξωκυττάριου συνδέτη στον GPCR
- Ο GPCR αλλάζει διαμόρφωση και δρα ως GEF (Guanine Exchange Factor)
- Αντικατάσταση GDP με GTP στο Gα → ενεργοποίηση
3️ Διαχωρισμός υπομονάδων
- Το Gα–GTP αποχωρίζεται από το σύμπλοκο Gβγ
- Και τα δύο τμήματα ενεργοποιούν διαφορετικούς ενδοκυττάριους
στόχους
4️ Τερματισμός σήματος
- Το Gα υδρολύει το GTP σε GDP (χάρη στην GTPάση του)
- Επανένωση με Gβγ → επιστροφή στην ανενεργή μορφή
Αιτιολογία
Η σποραδική συχνότητα εμφάνισης και η εστιακή
φύση του SWS υποδηλώνουν την παρουσία σωματικών μεταλλάξεων. Η
αλληλούχιση ολόκληρου του γονιδιώματος από το προσβεβλημένο και μη
προσβεβλημένο δέρμα τριών ασθενών με SWS εντόπισε μια μονονουκλεοτιδική
παραλλαγή (c.548G→A, p.Arg183Gln) στο γονίδιο GNAQ. Άλλοι έχουν
επιβεβαιώσει αυτήν τη μετάλλαξη σε δείγματα προσβεβλημένου ιστού από το 88% των
ασθενών με SWS (23 από τους 26) από μια μεγαλύτερη ομάδα, καθώς και από το 92%
των συμμετεχόντων (12 από τους 13) με προφανώς μη συνδρομικά σημάδια Port-Wine
(PWBs). Ο εγκεφαλικός ιστός από ασθενείς με SWS καταδεικνύει επίσης την ίδια
αλλαγή στο γονίδιο GNAQ. Αυτά τα αποτελέσματα υποδηλώνουν έντονα ότι το SWS
εμφανίζεται ως αποτέλεσμα μωσαϊκών μεταλλάξεων στο GNAQ. Τελικό αποτέλεσμα είναι ότι η μετάλλαξη στο γονίδιο GNAQ κωδικοποιεί για μια ελαφρώς τροποποιημένη πρωτεΐνη GNAQ στην
οποία ένα από τα αμινοξέα της αλλάζει: το R στη θέση 183 γίνεται Q.
Στο SWS, η μετάλλαξη R183Q του GNAQ θεωρείται ότι
υπερενεργοποιεί την καθοδική
σηματοδοτική οδό Ras/Raf/MEK/ERK και άλλες βασικές οδούς όπως η δραστηριότητα
mTOR. Το υπόλειμμα R183 GNAQ βρίσκεται στο κέντρο της υδρόφοβης σχισμής μεταξύ
2 συνδετικών τμημάτων που συνδέουν την GTPάση και τις ελικοειδείς περιοχές του
Gαq. Η υπολογιστική ανάλυση της μετάλλαξης R183Q GNAQ13 υποδηλώνει ότι η
μετάλλαξη επηρεάζει αρνητικά τον σχηματισμό του δεσμού υδρογόνου μεταξύ του
υπολείμματος R183 και του μορίου GDP, γεγονός που αποσταθεροποιεί τη διαμόρφωση
του ανενεργού δεσμού GDP του μετάλλαγματος Gαq. Αυτή η αλλοίωση προβλέπεται να
μειώσει Q
-την αυτοϋδρόλυση του GTP σε GDP
-την επανασυναρμολόγηση του τριμερούς συμπλόκου
G-πρωτεΐνης
-την απενεργοποίηση του Gαq
με αποτέλεσμα μια συστατική υπερενεργοποίηση των καθοδικών
σηματοδοτικών οδών.
Γονιδιακός τόπος : χρωμόσωμα 9q21
Άλλοι γονιδιακοί τόποι είναι το GNA11 στο χρωμόσωμα 19p13.3 (σωματική μετάλλαξη, MAPK σηματοδότηση) και το GNB2 στο χρωμόσωμα 7q22.1 (σωματική μετάλλαξη, YAP (yes-associated
protein) στην Hippo σηματοδοτική οδό)
Η μετάλλαξη GNAQ p.R183Q είναι εμπλουτισμένη με
ενδοθηλιακά κύτταρα σε εγκεφαλικές αλλοιώσεις SWS, αποκαλύπτοντας έτσι τα ενδοθηλιακά
κύτταρα ως πηγή ανώμαλης σηματοδότησης Gαq.
Ο χρονισμός της σωματικής μετάλλαξης στο GNAQ
κατά την ανάπτυξη πιθανότατα επηρεάζει τον κλινικό φαινότυπο. Η χαμηλή ροή της
λεπτομηνιγγικής τριχοειδικής δυσπλασίας φαίνεται να οδηγεί σε χρόνια υποξική
κατάσταση που οδηγεί σε φλοιώδη ατροφία και ασβεστώσεις.
Η υποξία δρα ως ισχυρό ερέθισμα για την αγγειογένεση, μέσω του μονοπατιού HIF–VEGF, τόσο σε φυσιολογικές (επούλωση τραύματος) όσο και σε παθολογικές καταστάσεις (όγκοι, ΧΑΠ, διαβήτης,SWS) .
Ο VEGF ασκεί τις δραστηριότητές του μέσω 2 υποδοχέων
τυροσινικής κινάσης (RTK), VEGFR2 και VEGFR1, με τη νευροπιλίνη να δρα ως συνυποδοχέας. Τα
καθοδικά σηματοδοτικά συμβάντα που προκαλούνται από τον VEGF περιλαμβάνουν
:
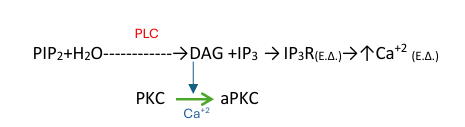
-τη φωσφορυλίωση σερίνης της PLCβ3
-τη φωσφορυλίωση τυροσινίνης των PI3K και PLCγ.
Από τις ισομορφές της PLC που
εκφράζονται σε ενδοθηλιακά κύτταρα, μόνο η PLCβ3 και η PLCγ αυξάνουν
σημαντικά την υδρόλυση της 4,5-διφωσφορικής φωσφατιδυλοϊνοσιτόλης μετά από
διέγερση με VEGF. Ενώ έχει αποδειχθεί ότι η PLCγ προάγει την επαγόμενη από VEGF αγγειακή
διαπερατότητα μέσω ενός ενδοκυτταρικού μηχανισμού που εξαρτάται από το Ca2+, είναι
γνωστό επίσης ότι η PLCβ3 δρα ως ένας αρνητικός ρυθμιστής της υπερδιαπερατότητας που προκαλείται
από VEGF μέσω ενός παρόμοιου μηχανισμού. Αυτό έχει ως αποτέλεσμα να μην γίνεται
εξαγγείωση των πρωτεϊνών του πλάσματος στον περιβάλλοντα ιστό και να μην
αναπτύσσεται μια προσωρινή μήτρα ικανή να υποστηρίξει την αγγειακή βλάστηση και
την ανάπτυξη όγκου.
PLC: PLCβ3→↓διαπερατότητας των αγγείων→↓ανάπτυξη μήτρας
PLCγ→↑διαπερατότητας αγγείων →↑ανάπτυξη μήτρας
Από το 2022 είναι γνωστό ότι η Gαq-R183Q μετάλλαξη, όταν εκφράζεται σε ενδοθηλιακά
κύτταρα, δημιουργεί μια σταθερά ενεργή σηματοδότηση PLCβ3 που οδηγεί σε
αυξημένη ANGPT2 (αγγειοποιητίνη 2) και έναν προαγγειογενετικό, προφλεγμονώδη
φαινότυπο. Οι ενδοθηλιοκυτταρικές-R183Q είναι επαρκείς για να σχηματίσουν
διευρυμένα αγγεία τύπου τριχοειδικών δυσπλασιών σε ποντίκια και η καταστολή της
ANGPT2 αποτρέπει τη διεύρυνση των αγγείων. Άρα η ενδοθηλιακή GαqR183Q είναι υπεύθυνη για την τριχοειδική
διεύρυνση και επομένως αναγνωρίζεται η ANGPT2 ως παράγοντας που συμβάλλει στον
αγγειακό φαινότυπο της αγγειακής βλάβης.
Κλινικές Εκδηλώσεις
Ο Αγγειωματώδης Σπίλος του προσώπου (PWBs) ή Τριχοειδική Δυσπλασία είναι παρών κατά τη γέννηση, αλλά δεν σχετίζεται πάντα με το σύνδρομο Sturge-Weber (SWS). Στην πραγματικότητα, η συνολική συχνότητα εμφάνισης του SWS έχει αναφερθεί ότι είναι 20-50% σε άτομα με PWB που περιλαμβάνει το μέτωπο και το άνω βλέφαρο. Το PWB τείνει να είναι μονομερές και ομόπλευρο με την εγκεφαλική συμμετοχή. Η τριχοειδική δυσπλασία μπορεί επίσης να είναι εμφανής στο κάτω μέρος του προσώπου και του κορμού και στον βλεννογόνο του στόματος και του φάρυγγα. Ο βούφθαλμος και το γλαύκωμα του ομόπλευρου οφθαλμού είναι συχνές επιπλοκές.
Οι επιληπτικές κρίσεις εμφανίζονται στο
75-80% όλων των ασθενών με SWS και σε πάνω από 90% αυτών με αμφοτερόπλευρη
εγκεφαλική εμπλοκή. Η πρώιμη έναρξη των κρίσεων πιθανότατα θα συμβεί
κατά τη διάρκεια του 1ου έτους της ζωής, αλλά σπάνια κατά τη διάρκεια του 1ου
μήνα της ζωής, και είναι συνήθως εστιακές κλονικές και αντίπλευρες στην πλευρά
της τριχοειδικής δυσπλασίας του προσώπου. Μπορεί να γίνουν ανθεκτικές στα αντιεπιληπτικά
και συχνά σχετίζονται με status epilepticus. Το ένα τρίτο των παιδιών με ανίατη
επιληψία που σχετίζεται με SWS εμφανίζουν επεισόδια παρατεταμένων μετακριτικών
ελλειμμάτων, τα οποία διαρκούν από 1 ημέρα έως μερικά χρόνια, μέχρι να
ανακάμψουν στην αρχική τους κατάσταση. Μερικοί ασθενείς αναπτύσσουν επίσης αργά
προοδευτική ημιπάρεση.
Τα παροδικά επεισόδια που μοιάζουν με
εγκεφαλικό επεισόδιο ή τα οπτικά ελαττώματα που επιμένουν για αρκετές
ημέρες και δεν σχετίζονται με την επιληπτική δραστηριότητα είναι συχνά και
πιθανώς προκύπτουν από θρόμβωση των φλοιωδών φλεβών στην πληγείσα περιοχή.
Αν και η νευροανάπτυξη φαίνεται να είναι
φυσιολογική κατά το πρώτο έτος της ζωής, η νοητική υστέρηση ή οι σοβαρές
μαθησιακές δυσκολίες εμφανίζονται σε τουλάχιστον 50% των ασθενών στην όψιμη
παιδική ηλικία, πιθανώς αποτέλεσμα της δύσκολα αντιμετωπιζόμενης επιληψίας και
αυξανόμενης εγκεφαλικής ατροφίας. Ο βαθμός της οπτικής βλάβης, η ημιπάρεση, η
συχνότητα των κρίσεων και η γνωστική λειτουργία (με βάση την ηλικιακή ομάδα:
βρέφος/παιδί προσχολικής ηλικίας, παιδί και ενήλικας) μπορούν να αξιολογηθούν
χρησιμοποιώντας ένα επικυρωμένο νευρολογικό σύστημα αξιολόγησης SWS.
Έως και 50% των ασθενών με SWS έχουν ποικίλο
βαθμό οφθαλμικών ανωμαλιών. Οι δύο πιο συχνές εκδηλώσεις περιλαμβάνουν :
-το γλαύκωμα
-την παρουσία χοριοειδικών αιμαγγειωμάτων.
Άλλες αγγειακές ανωμαλίες του οφθαλμού
μπορούν να επηρεάσουν τον επιπεφυκότα, τον επισκληρίδιο, τον αμφιβληστροειδή
ή/και τον χοριοειδή, γεγονός που μπορεί να οδηγήσει σε οπτική ατροφία
και τύφλωση.
Το χοριοειδές αιμαγγείωμα (CH), το οποίο είναι
ένας καλοήθης αγγειακός όγκος, είναι συχνό στο 40% έως 50% των ασθενών με SWS.
Έχει πιο συχνά διάχυτη φύση, αλλά μπορεί να είναι περιορισμένο και συνήθως
είναι ομόπλευρο με το PWB του προσώπου. Προκαλείται από ανώμαλα και διευρυμένα
αγγεία και αγγειακά κανάλια που προκαλούν ποικίλα κλινικά χαρακτηριστικά, όπως μειωμένη
οπτική οξύτητα, διαθλαστικά σφάλματα, σκότωμα ή αποκόλληση
αμφιβληστροειδούς.
|
Κλινικές Εκδηλώσεις που Πρέπει να Αξιολογηθούν και να Παρακολουθηθούν |
|
|
ΔΕΡΜΑ |
● Αγγειωματώδης Σπίλος Προσώπου ● Αγγειακές βλάβες & Αγγειωματώδης Σπίλος αλλού ● Υπερανάπτυξη |
|
ΝΕΥΡΙΚΟ ΣΥΣΤΗΜΑ |
● Επιληπτικές κρίσεις ή επιληψία ● Πονοκέφαλοι ● Συμβάντα που μοιάζουν με εγκεφαλικό επεισόδιο ● Γνωστική εξασθένηση ● Λεπτομηνιγγική αγγειωμάτωση ● Άλλες δομικές ανωμαλίες του εγκεφάλου |
|
ΟΦΘΑΛΜΟΙ |
● Γλαύκωμα ● Χοριοειδικά ή Επισκληρικά Αιμαγγειώματα ● Ελαττώματα οπτικού πεδίου ● Απόφραξη αμφιβληστροειδούς ● Οφθαλμική μελανοκυττάρωση |
|
ΟΣΤΑ |
● Ασυμμετρία ανάπτυξης ● Υπερτροφία ή υποτροφία ● Δευτεροπαθής σκολίωση ● Λειτουργικοί περιορισμοί |
|
ΔΟΝΤΙΑ |
● Αγγειωμάτωση ούλων και υπερώας ● Υπερπλασία ούλων ● Προεγχειρητικός και διεγχειρητικός σχεδιασμός
για οδοντιατρικές επεμβάσεις/επεμβάσεις |
|
ΝΕΦΡΟΙ |
● Νεφρική Υπέρταση |
|
ΕΝΔΟΚΡΙΝΕΙΣ ΑΔΕΝΕΣ |
● Υποθαλαμικός Υποϋποφυσισμός ● Υποθυρεοειδισμός ● Ανεπάρκεια αυξητικής ορμόνης |
Αν και η νευροανάπτυξη φαίνεται να είναι φυσιολογική κατά το πρώτο έτος της ζωής, η νοητική υστέρηση ή οι σοβαρές μαθησιακές δυσκολίες εμφανίζονται σε τουλάχιστον 50% των ασθενών στην όψιμη παιδική ηλικία, πιθανώς αποτέλεσμα της δύσκολα αντιμετωπιζόμενης επιληψίας και αυξανόμενης εγκεφαλικής ατροφίας. Ο βαθμός προσβολής του οπτικού πεδίου, η ημιπάρεση, η συχνότητα των κρίσεων και η γνωστική λειτουργία (με βάση την ηλικιακή ομάδα: βρέφος/παιδί προσχολικής ηλικίας, παιδί και ενήλικας) μπορούν να αξιολογηθούν χρησιμοποιώντας ένα επικυρωμένο νευρολογικό σύστημα αξιολόγησης SWS.
Διαφορική Διάγνωση
Ένα PWB, ειδικά όταν βρίσκεται στη μέση γραμμή
του μετώπου, πρέπει να διαφοροποιείται από τον απλό
σπίλο (NS), κοινώς γνωστό ως φιλί
αγγέλου. Το NS που περιλαμβάνει τη μέση γραμμή του μετώπου είναι
σημαντικά πιο συχνό από ένα PWB στην ίδια θέση που θα διατρέχει κίνδυνο για
SWS, κάτι που είναι σπάνιο. Σε αντίθεση με το PWB, το NS τείνει να έχει
ανοιχτότερο κόκκινο χρώμα και να είναι δυσδιάκριτο με ασαφή όρια. Επιπλέον, ένα
νεογέννητο με μεσόφρυο NS θα έχει συχνά εμφανή NS σε άλλες κοινές θέσεις, όπως
τα άνω βλέφαρα, το περιρινικό δέρμα, το φίλτρο και την ινιακή περιοχή. Επίσης,
σε αντίθεση με τα PWB, τα οποία επιμένουν καθ' όλη τη διάρκεια της ζωής, το NS
είναι συνήθως παροδικής φύσης, συνήθως εξασθενίζοντας κατά τη διάρκεια του
πρώτου έτους, αν και το NS που εντοπίζεται στο μεσόφρυο ή την ινιακή περιοχή μπορεί
μερικές φορές να επιμένει. Σε
περιπτώσεις αβεβαιότητας, συνιστάται η παραπομπή σε αγγεολόγο για οριστική
διάγνωση πριν από την εφαρμογή αξιολόγησης για SWS.
Αν και σπάνιες, 2 άλλες οντότητες που μπορούν
αρχικά να διαγνωστούν λανθασμένα ως PWB περιλαμβάνουν την αρτηριοφλεβώδη δυσπλασία(AVM) και τη Μορφέα.
Η AVM μπορεί να είναι συγγενής ή επίκτητη και
μπορεί να επηρεάσει το μέτωπο. Ωστόσο, με την πάροδο του χρόνου μια AVM θα
αναπτύξει χαρακτηριστικά, όπως αυξημένη θερμότητα, παλμικότητα, οίδημα ή/και
φλέβες που εκβάλλουν, που θα διακρίνουν τη βλάβη αυτή ως ένα αγγειακό σημάδι υψηλής ροής διακριτό από
την PWB. Ο έλεγχος για AVM μπορεί να πραγματοποιηθεί με υπερηχογράφημα Doppler.
Η Μορφέα (en coupe de sabre) είναι μια
φλεγμονώδης δερματική πάθηση που μπορεί να εμφανιστεί στο μέτωπο παρόμοια με
τις PWBs σε γραμμικό μοτίβο, αλλά συνήθως είναι μια επίκτητη διαταραχή
σε σύγκριση με τις PWBs, οι οποίες υπάρχουν εκ γενετής. Με την πάροδο του
χρόνου, η μορφέα εξελίσσεται σε ουλώδη εμφάνιση με οστεώδες, σφιχτό δέρμα,
ατροφία, δυσμελάγχρωση και τριχόπτωση όταν η πάθηση επεκτείνεται στο τριχωτό
της κεφαλής ή στο μέτωπο. Η διάγνωση της μορφέας συνήθως γίνεται κλινικά, αλλά
μπορεί να επιβεβαιωθεί και παθολογοαναντομικά.
Διάγνωση
Ο γονιδιακός έλεγχος είναι απαραίτητος για
τη διαφοροδιάγνωση μεταξύ των 3 υπεύθυνων γονιδίων για το SWS
Η μαγνητική τομογραφία εγκεφάλου με
σκιαγραφικό είναι η απεικονιστική μέθοδος εκλογής για την επίδειξη της
επέκτασης της τριχοειδικής δυσπλασίας του λεπτομηνιγγικού ιστού (SWS) . Οι
ανωμαλίες της λευκής ουσίας είναι συχνές και πιστεύεται ότι είναι αποτέλεσμα
χρόνιας υποξίας.
Φυσικά σε περίπτωση εμφάνισης κρίσεων το ΗΕΓ
είναι η εξέταση επιλογής
Συχνά, η ατροφία παρατηρείται ομόπλευρα με την
τριχοειδική δυσπλασία των λεπτομηνιγγικών αδένων. Οι ασβεστώσεις μπορούν να
παρατηρηθούν καλύτερα με αξονική τομογραφία κεφαλής. Το χοριοειδές
πλέγμα είναι συχνά διευρυμένο και ο βαθμός διεύρυνσης του πλέγματος δείχνει
θετική συσχέτιση με την έκταση της τριχοειδικής δυσπλασίας των λεπτομηνιγγικών
αδένων.
Η τομογραφία εκπομπής ποζιτρονίων με χρήση 18F-δεοξυγλυκόζης έχει χρησιμοποιηθεί για τη μελέτη του εγκεφαλικού μεταβολισμού σε ασθενείς με SWS και έχει αποδειχθεί χρήσιμη για τον χειρουργικό σχεδιασμό και την πρόγνωση.
Η οφθαλμολογική αξιολόγηση που εξετάζει
για γλαύκωμα είναι επίσης απαραίτητη και αποτελεί δια βίου φροντίδα, επειδή οι
οφθαλμικές επιπλοκές μπορούν να εμφανιστούν οποιαδήποτε στιγμή κατά τη διάρκεια
της ζωής.
Με βάση τη συμμετοχή του εγκεφάλου και του
προσώπου, υπάρχουν τρεις τύποι SWS στην Κλίμακα Roach:
Τύπος Ι—Υπάρχουν αγγειώματα τόσο του προσώπου όσο
και των λεπτομηνιγγικών αγγείων. Μπορεί να υπάρχει γλαύκωμα.
Τύπος II—Μόνο αγγειώματα προσώπου (χωρίς
συμμετοχή του ΚΝΣ). Μπορεί να υπάρχει γλαύκωμα.
Τύπος III—Μεμονωμένα λεπτομηνιγγικά αγγειώματα.
Συνήθως χωρίς γλαύκωμα.
Επιπλέον, υπάρχει σύνδρομο επικάλυψης μεταξύ SWS
και συνδρόμου Klippel-Trenaunay (μικτές τριχοειδείς, φλεβικές ή λεμφικές
δυσπλασίες που εμπλέκουν οστά και μυς στο ένα άκρο).
Αντιμετώπιση
Η διαχείριση του SWS είναι συμπτωματική και
διεπιστημονική, αλλά δεν έχει μελετηθεί επαρκώς από προοπτικές μελέτες. Η
ανακάλυψη της αιτιολογικής σωματικής μωσαϊκής μετάλλαξης υποδηλώνει νέες
γνώσεις για την παθοφυσιολογία αυτής της αγγειακής δυσπλασίας και πιθανές νέες
στρατηγικές θεραπείας για μελλοντική μελέτη.
Η θεραπεία στοχεύει :
-στον έλεγχο των επιληπτικών κρίσεων
-στην ανακούφιση από πονοκεφάλους
-στην πρόληψη επεισοδίων που μοιάζουν με
εγκεφαλικό επεισόδιο, καθώς και
-στην παρακολούθηση του γλαυκώματος
-στη θεραπεία με λέιζερ για τις δερματικές
τριχοειδείς δυσπλασίες.
Οι επιληπτικές κρίσεις που ξεκινούν στη βρεφική
ηλικία δεν σχετίζονται πάντα με κακό νευροαναπτυξιακό αποτέλεσμα. Για
ασθενείς με καλά ελεγχόμενες κρίσεις και φυσιολογική ή σχεδόν φυσιολογική
ανάπτυξη, η αντιμετώπιση συνίσταται σε αντιεπιληπτικά φάρμακα και
παρακολούθηση για επιπλοκές, όπως γλαύκωμα, βουφθαλμία και ανωμαλίες
συμπεριφοράς. Εάν οι κρίσεις είναι ανθεκτικές στην αντισπασμωδική θεραπεία,
ειδικά στη βρεφική ηλικία και τα πρώτα 1 έως 2 χρόνια, και προέρχονται κυρίως
από το ένα ημισφαίριο, τα περισσότερα ιατρικά κέντρα συμβουλεύουν ημισφαιρεκτομή.
Η χρήση χαμηλής δόσης ασπιρίνης εξακολουθεί να είναι αμφιλεγόμενη. Το φάρμακο
δεν χρησιμοποιείται συστηματικά, αλλά ασθενείς με επεισόδια που μοιάζουν με
εγκεφαλικό επεισόδιο και συχνές ανθεκτικές κρίσεις μπορεί να ωφεληθούν από αυτή
τη μορφή θεραπείας.
Λόγω του κινδύνου γλαυκώματος, ενδείκνυται
τακτική μέτρηση της ενδοφθάλμιας πίεσης και ανάλογη θεραπεία επί εμφάνισης γλαυκώματος.
Ο Αγγειωματώδης Σπίλος του πρόσωπου
αποτελεί συχνά στόχο χλευασμού από τους συμμαθητές, οδηγώντας σε ψυχολογικό
τραύμα. Η θεραπεία με παλμικό λέιζερ χρωστικής συχνά παρέχει
εξαιρετική εξάλειψη του σπίλου, ιδιαίτερα εάν βρίσκεται στο μέτωπο.
Η προσυμπτωματική αγωγή αφορά την έναρξη
χαμηλής δόσης ασπιρίνης και αντιεπιληπτικών με σκοπό την καθυστέρηση της έναρξης
των συμπτωμάτων. Η καθυστέρηση της έναρξης των επιληπτικών κρίσεων σε βρέφη με
προσυμπτωματική θεραπεία επιτρέπει πιο φυσιολογική νευρολογική ανάπτυξη με
χαμηλότερη πιθανότητα μελλοντικής εγκεφαλικής βλάβης και γνωστικής εξασθένησης.
Η αναστολή του mTOR επιτυγχάνεται με τη χορήγηση σιρόλιμους, επίσης γνωστό ως
ραπαμυκίνη, η οποία είναι ικανή να αναστείλει την οδό mTOR, και επομένως τη
σύνθεση πρωτεϊνών, προκαλώντας ταχεία απενεργοποίηση της S6K1, η οποία είναι
ένας καθοδικός στόχος της mTOR και απαραίτητη για τη φωσφορυλίωση της
ριβοσωμικής πρωτεΐνης S6, μιας πρωτεΐνης που εμπλέκεται άμεσα στη σύνθεση
πρωτεϊνών. Η S6K1, όταν είναι ενεργή, διευκολύνει την ενεργοποίηση της CREMτ, η
οποία ανήκει στην οικογένεια μεταγραφικών παραγόντων δέσμευσης στοιχείων
απόκρισης cAMP, και προκαλεί περαιτέρω μεταγραφή γονιδίων και μεταγραφή του
πυρηνικού αντιγόνου πολλαπλασιαστικών κυττάρων (PCNA), το οποίο παίζει
σημαντικό ρόλο στον κυτταρικό πολλαπλασιασμό και τη σύνθεση DNA στη φάση S του
κυτταρικού κύκλου. Μέσω της απενεργοποίησης της S6K1, το σιρόλιμους είναι ικανό
να αναστείλει αυτά τα καθοδικά συμβάντα.
Η κανναβιδιόλη (CBD) έχει αναδειχθεί ως
νέα θεραπευτική ουσία για πολλές πτυχές της υγείας, όπως το άγχος, η κατάθλιψη,
η αϋπνία, η διαταραχή μετατραυματικού στρες και η σχιζοφρένεια, μεταξύ άλλων
ασθενειών. Υπάρχει αυξανόμενη βιβλιογραφία σχετικά με την CBD και την πιθανή εφαρμογή
και τα οφέλη της όσον αφορά την επιληψία και τις επιληπτικές διαταραχές. Το
2018, ο FDA ενέκρινε το Epidiolex, επίσης γνωστό ως κανναβιδιόλη (CBD), για τη
θεραπεία επιληπτικών κρίσεων για δύο ξεχωριστές παιδιατρικές διαταραχές, το
σύνδρομο Lennox-Gastaut και το σύνδρομο Dravet, τα οποία και τα δύο αφορούν
επιληψία. Το Εpidiolex έχει επίσης χρησιμοποιηθεί σε κλινικές δοκιμές που
αφορούσαν μόνο ασθενείς με SWS. Υποστηρίζεται ότι η CBD έχει
νευροπροστατευτικές ικανότητες αναστέλλοντας έμμεσα την οδό mTOR μέσω αναστολής
JNK. Είναι ένα κανναβινοειδές χωρίς ψυχοδραστικές ιδιότητες και η χορήγησή του
έχει αποδειχθεί ασφαλής και αποτελεσματική για ασθενείς με ανθεκτική στη
θεραπεία επιληψία.